Un team di ricerca dell’Irccs Ospedale San Raffaele di Milano e dell’Istituto di neuroscienze del Consiglio nazionale delle ricerche (Cnr-In) ha scoperto il meccanismo di azione di un gene (Setd5) la cui mutazione è associata ad alcune forme di disabilità intellettive, spesso accompagnate da manifestazioni autistiche. Lo studio, svolto in collaborazione con le università di Trento e Pisa, è pubblicato su Neuron
I disturbi del neurosviluppo sono un insieme ampio di patologie neurologiche e psichiatriche che si manifestano durante l’età dello sviluppo e di cui fanno parte le disabilità intellettive e i disturbi nello spettro autistico. Si tratta di condizioni complesse e molto diversificate tra loro, causate da un insieme di fattori sia genetici sia ambientali.

Un gruppo di ricercatori dell’Irccs Ospedale San Raffaele di Milano e dell’Istituto di neuroscienze del Consiglio nazionale delle ricerche (Cnr-In) coordinati dai dottori Alessandro Sessa e Vania Broccoli, in collaborazione con i gruppi delle università di Trento e Pisa – coordinati rispettivamente dal dottor Alessio Zippo e dal professor Massimiliano Andreazzoli – ha scoperto il meccanismo di azione di un gene (Setd5) la cui mutazione è associata ad alcune forme di disabilità intellettive spesso accompagnate da manifestazioni autistiche. I risultati dello studio pubblicato oggi sulla prestigiosa rivista internazionale Neuron, dimostrano che Setd5 codifica per una proteina con un ruolo fondamentale e inatteso all’interno del nucleo dei neuroni: quello di assicurare la corretta trascrizione delle informazioni del Dna. La scoperta apre nuove prospettive nello studio di questi disturbi e getta le basi per l’identificazione di futuri bersagli terapeutici.
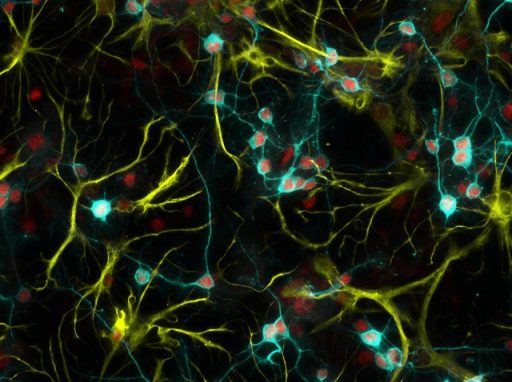
Le disabilità intellettive, come molti altri disturbi del neurosviluppo, sono condizioni altamente complesse: grazie al lavoro di gruppi di ricerca di tutto il mondo, oggi sappiamo che possono essere associate a mutazioni di moltissimi geni diversi. Tra questi c’è un gene chiamato Setd5, che quando non più funzionante dà origine a forme di disabilità intellettiva che colpiscono in particolare il linguaggio e il movimento, oltre a comportamenti tipici dello spettro ossessivo-compulsivo e dello spettro autistico. Sebbene questo sia noto da tempo, fino a oggi non era chiara quale fosse l’esatta funzione di Setd5, né il meccanismo per il quale, a fronte di mutazioni che mettono il gene fuori gioco, si manifestino problemi nello sviluppo del sistema nervoso.
Attraverso lo studio di sistemi cellulari e modelli animali della mutazione, i ricercatori hanno scoperto che Setd5 gioca un ruolo chiave per la struttura del Dna e quindi per il corretto recupero delle informazioni in esso presenti. Queste informazioni infatti, per poter essere utilizzate, devono prima essere trascritte in un’altra forma – l’Rna, una sorta di copia carbone del Dna – e portate fuori dal nucleo. Setd5 è coinvolto proprio nel regolare questo delicato processo di trascrizione delle informazioni.
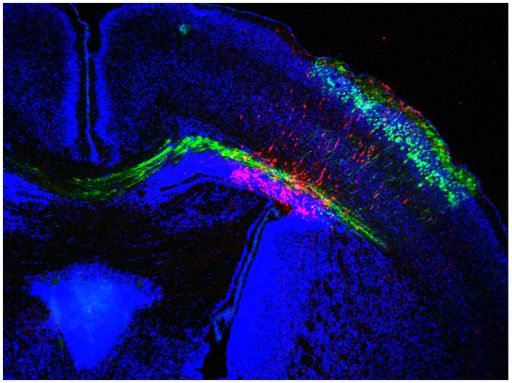
“Setd5 rappresenta una sorta di ‘architetto molecolare’ che regola la complessa organizzazione del Dna dei neuroni del nostro cervello. Quando è fuori gioco, le informazioni contenute nel Dna vengono trascritte in maniera alterata ed incompleta”, spiega Alessandro Sessa, coordinatore della ricerca e primo autore dello studio. “Secondo quando abbiamo osservato, questo impatta in particolare sulla formazione e sul corretto funzionamento dei neuroni. Come conseguenza i topi privi del gene Setd5 mostrano comportamenti anomali sia dal punto di vista cognitivo che sociale”.

Nonostante le mutazioni nel gene Setd5 rappresentino la causa genetica solo di una porzione dei casi disabilità intellettive e autismo, i meccanismi individuati potrebbero essere comuni anche ad altri geni che svolgono funzionalità simili, oltre a suggerire nuove ipotesi di ricerca: “Conoscere il meccanismo molecolare alla base di una patologia è il primo passo per individuare dei possibili bersagli terapeutici”, conclude Sessa.

La ricerca è stata finanziata dal Ministero della Salute e da Fondazione Telethon.








